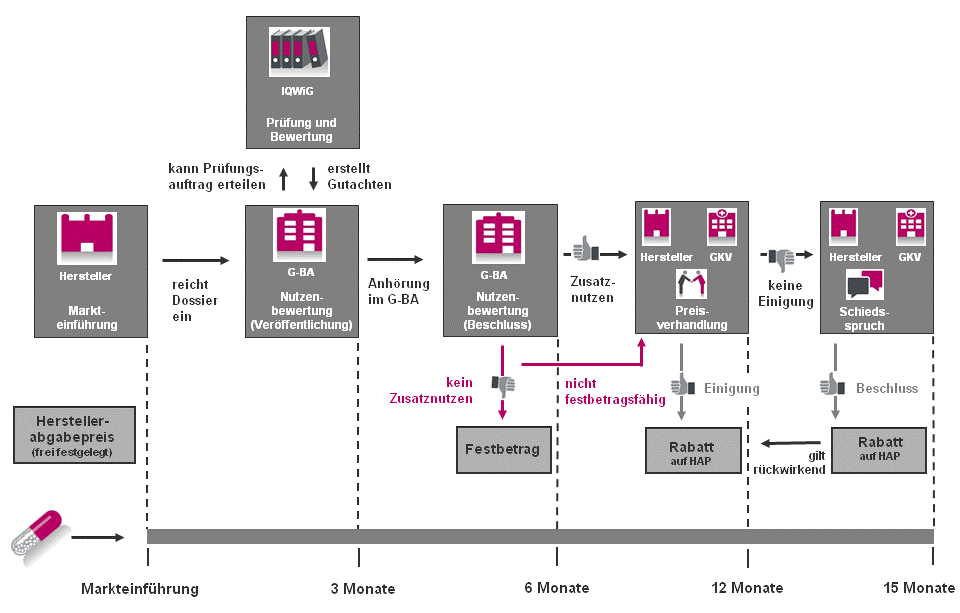
In Deutschland sind pharmazeutische Unternehmer nach § 35a SGB V verpflichtet, bei der Markteinführung eines neuen Arzneimittels zu belegen, ob und in welchem Ausmaß ihr Medikament einen Zusatznutzen gegenüber der zweckmäßigen Vergleichstherapie hat.
Die Nachweispflicht gilt in folgenden Fällen:
- Für alle nach dem 1. Januar 2011 erstmals in Verkehr gebrachte Wirkstoffe.
- Bei neuen Anwendungsgebieten für nach dem 1. Januar 2011 erstmals in Verkehr gebrachte Wirkstoffe.
- Bei neuen Anwendungsgebieten für vor dem 1. Januar 2011 in Verkehr gebrachte Wirkstoffe, wenn der Gemeinsame Bundesausschuss für das Arzneimittel bereits eine Nutzenbewertung veranlasst hat.
- Auf Antrag des pharmazeutischen Unternehmers oder des Gemeinsamen Bundesausschusses frühestens ein Jahr nach Beschluss bei Vorliegen neuer Erkenntnisse.
- Nach Ablauf eines befristeten Beschlusses zur Nutzenbewertung.